责任编辑:冯瑞龙 审核人:苏和、张洁、傅琳 来源: 发布日期:2025年12月28日 23:20 访问量:28 字体大小:【大】【中】【小】
近日,以我校为第一完成单位,兽医学院博士研究生刘昊东为第一作者,我院畜牧兽医技术系杜晨光教授为通讯作者完成的研究成果"Paraventricular nucleus–locus coeruleus VGlut2 neural circuit regulates energy metabolism in mice"(下丘脑室旁核至蓝斑VGlut2神经环路调控能量代谢)发表在生物学领域国际权威期刊《Cell Death&Disease》上(中国科学院1区Top期刊,影响因子9.6)。该研究得到国家自然科学基金(32060204)等项目的资助和支持。

异常增重所导致的肥胖在人体是一个全球性健康危机,但在畜禽机体上在提高饲料转化等方面是一个值得深入探讨的课题,其核心在于能量摄入与消耗的长期失衡。下丘脑在整合外周代谢信号、调控能量平衡中发挥着核心作用。然而,高脂饮食(HFD)诱导肥胖的中枢神经机制仍不清楚。本研究采用病毒示踪、光遗传学、化学遗传学、纤维光度法和药理学阻断等多种技术手段,系统探究了下丘脑室旁核(PVH)谷氨酸能神经元及其下游神经环路在能量代谢中的作用。
研究发现,长期高脂饮食可特异性激活PVH区域的VGlut2谷氨酸能神经元。通过逆向跨多突触病毒示踪技术,研究团队鉴定出PVH VGlut2神经元直接支配棕色脂肪组织(IBAT),并在肥胖状态下呈现代偿性激活(图1)。纤维光度法钙信号记录显示,这些神经元在觅食阶段活性升高,而在进食过程中迅速被抑制,提示其参与进食行为的精细调控。
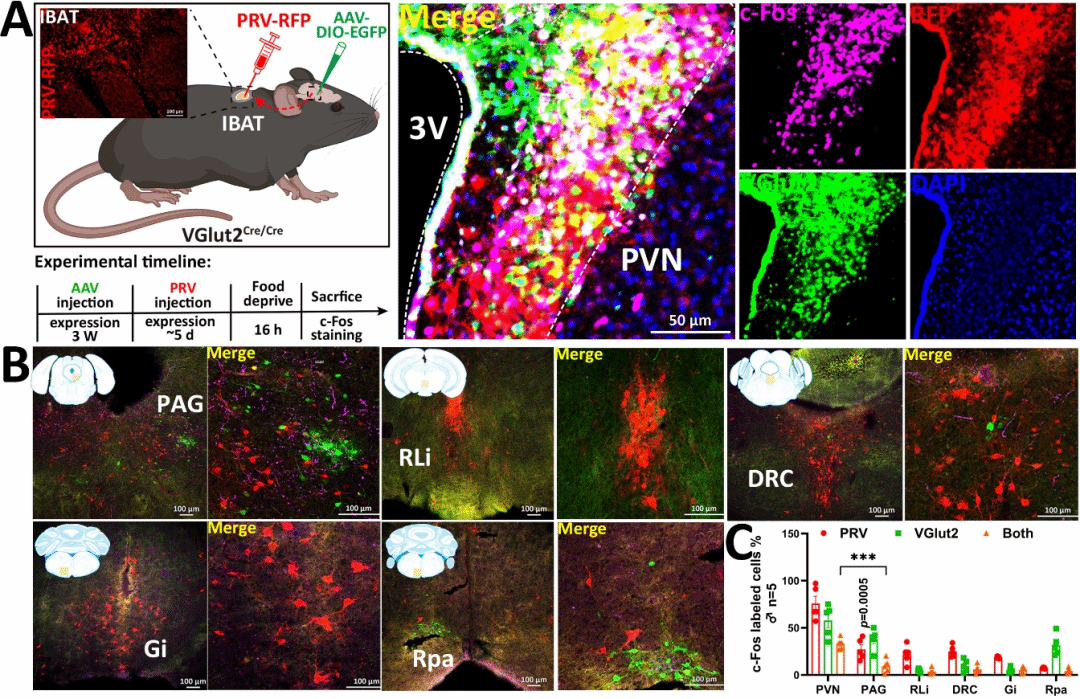
图1 高脂饮食激活PVH VGlut2神经元及其对IBAT的支配
光遗传学实验证实,激活PVH VGlut2神经元能够显著抑制食物摄入并提升IBAT产热功能,使小鼠核心体温升高;而抑制这些神经元则产生相反效应(图2)。进一步的顺向病毒示踪显示,PVH VGlut2神经元主要投射至蓝斑核(LC)—一个重要的脑干代谢调控中枢。
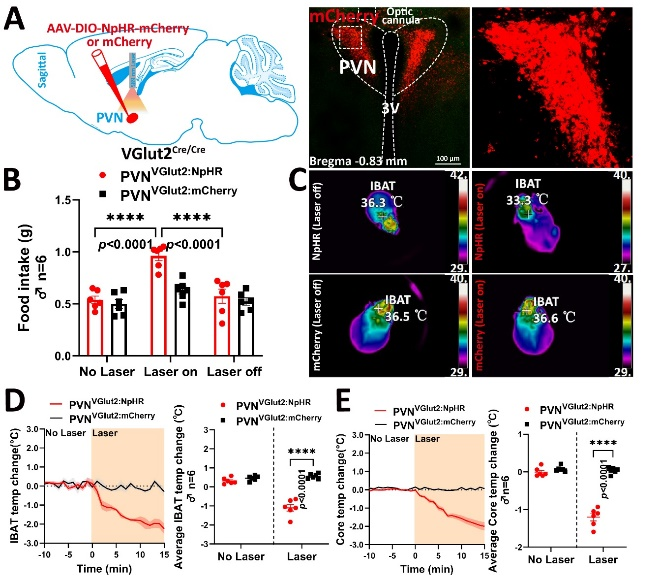
图2 光遗传调控PVH VGlut2神经元对进食和产热的双向调节
通过特异性标记PVH→LC神经投射,研究团队发现光遗传激活该环路同样能够抑制进食并增加iBAT温度。交感神经去神经支配实验证实,这一效应依赖于交感神经系统的完整性,揭示了PVH→LC→交感神经→iBAT这一完整的能量代谢调控通路(图3)。多通道电生理记录进一步验证了光刺激能够有效激活该神经环路。
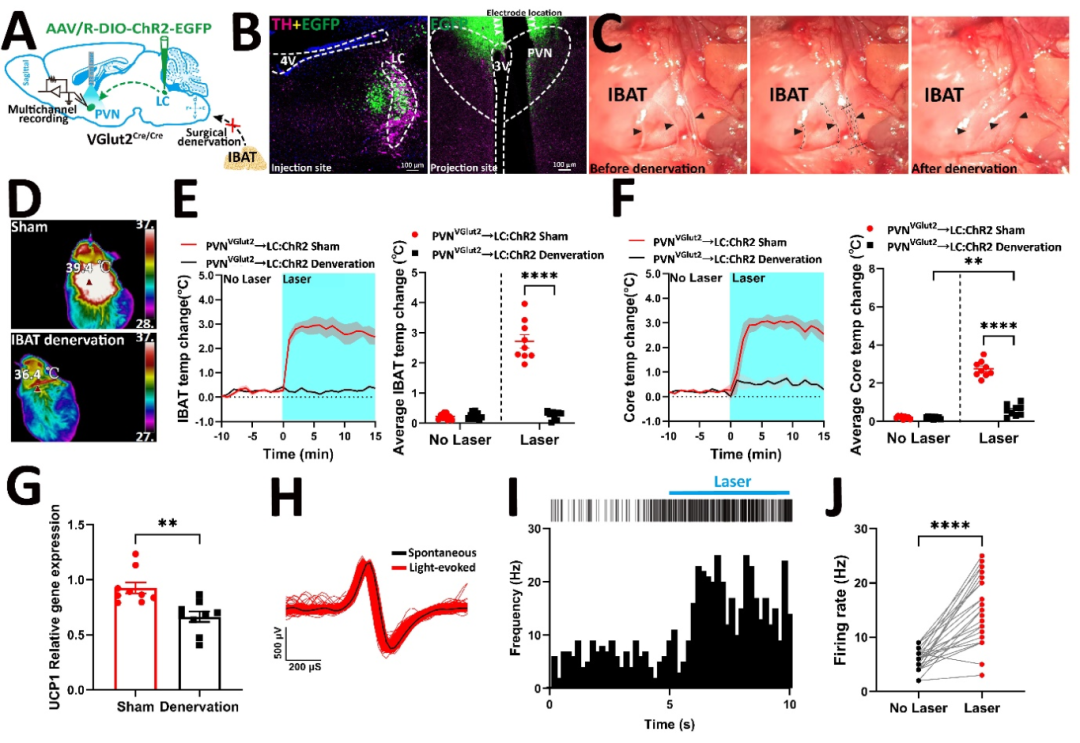
图3 PVH→LC→交感神经→iBAT神经调控通路
化学遗传学长期激活实验显示,持续激活PVH→LC神经环路两周能够显著降低肥胖小鼠体重,减少白色脂肪堆积,改善葡萄糖耐量和胰岛素敏感性,同时增加棕色脂肪重量和体温(图4)。这些结果表明,该神经环路的激活不仅能够逆转肥胖表型,还能改善相关的代谢紊乱。
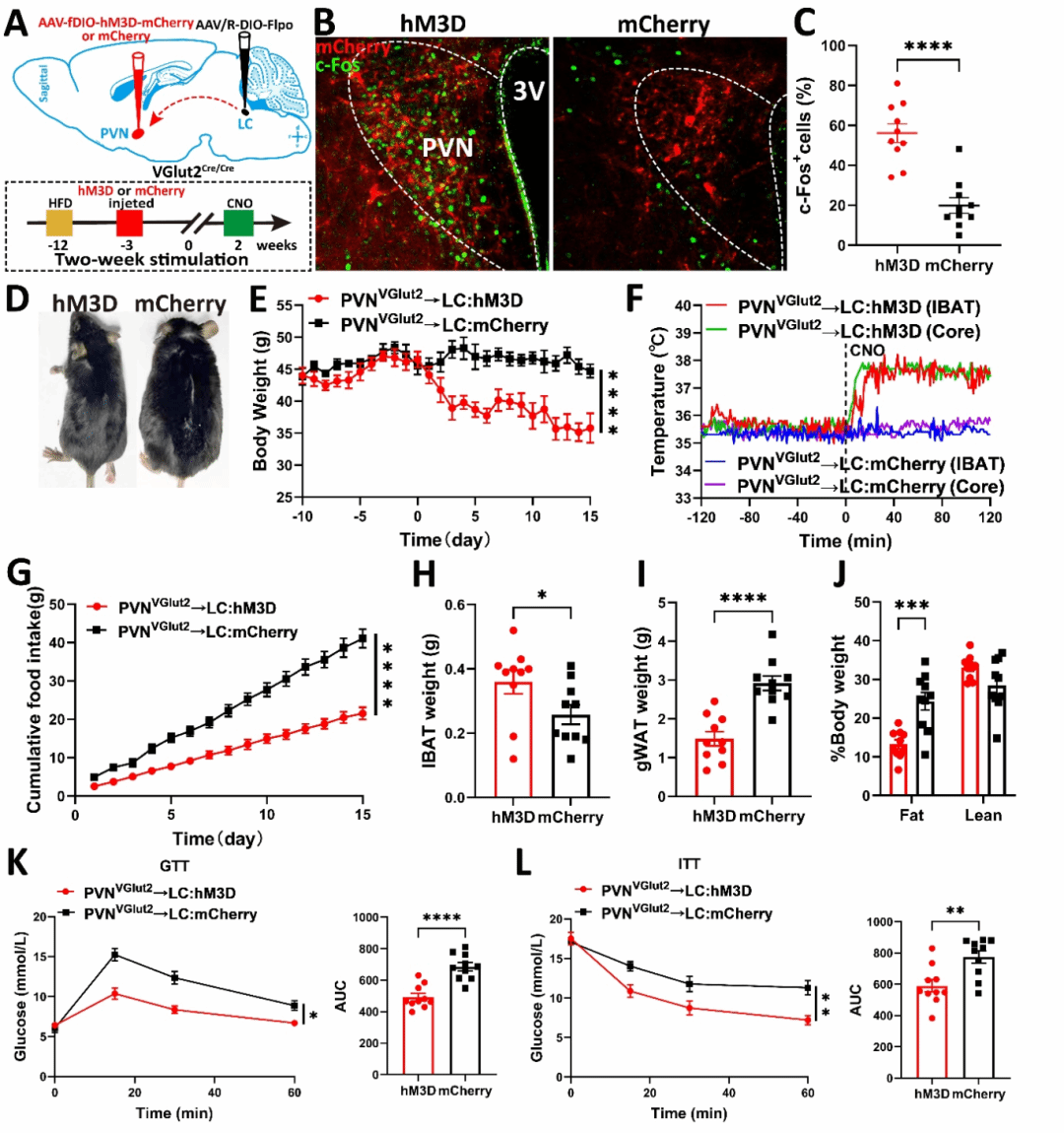
图4 长期激活PVH→LC环路改善高脂饮食诱导的肥胖和代谢紊乱
为阐明谷氨酸在该环路中的作用,研究团队利用破伤风毒素(TeNT)特异性阻断PVH→LC环路中的谷氨酸释放。结果显示,阻断谷氨酸释放后,小鼠快速出现肥胖表型,包括体重增加、脂肪堆积、葡萄糖代谢紊乱以及产热能力下降,证实了谷氨酸能信号传递在维持能量平衡中的关键作用。
本研究系统阐明了PVH VGlut2→LC神经环路通过整合进食抑制与外周产热信号来调控能量代谢的完整机制,为能量稳态失衡提供了潜在的神经调控干预靶点。该研究成果深化了对下丘脑-脑干交互作用在代谢调控中的理解,为基于神经环路的治疗策略以及畜禽个体快速育肥开发提供了理论基础和实验依据。未来,该团队将在大动物模型中验证这一发现,并探索非侵入性神经调控方法的实践转化潜力。